La majorité des adultes devront faire face, au cours de leur vie, à des pertes de masse et de force musculaire, un problème courant qui a un impact négatif sur la santé et la longévité. Par exemple, la sarcopénie, qui est la perte progressive de masse musculaire associée au vieillissement, augmente considérablement le risque de chutes, de fractures et de perte d’autonomie chez les personnes âgées. De plus, des conditions telles que l’atrophie musculaire due à l’inactivité ou à des maladies chroniques peuvent conduire à une diminution de la qualité de vie et à une augmentation de la morbidité.
« Mon équipe souhaite mieux comprendre les facteurs biologiques en vue de ralentir les processus délétères qui mènent à une perte de la fonction musculaire liée au vieillissement, mais aussi à d’autres conditions physiopathologiques ; on pense à des patients intubés aux soins intensifs pouvant développer des problèmes au diaphragme, un muscle qui nous permet de respirer », affirme Jean-Philippe Leduc-Gaudet, professeur au Département de biologie médicale de l’Université du Québec à Trois-Rivières (UQTR).

L’équipe d’étudiants du professeur Leduc-Gaudet. De gauche à droite : Zachary Bérubé-Gauthier (baccalauréat en biologie médicale), Suzanne Marie-Pierre Ina Lamizana (baccalauréat en biologie médicale), Anthony Capobianco (baccalauréat en biochimie et biotechnologie) et Justine Deshaies (baccalauréat en biologie médicale).
Pour ce jeune chercheur récipiendaire du Discovery Award 2024 de la Banting Research Foundation, déchiffrer les mécanismes cellulaires et moléculaires à l’origine de cette érosion musculaire devient une priorité cruciale afin de préserver la santé et la qualité de vie des personnes vieillissantes ou affectées par différentes conditions pathologiques.
Comprendre la santé du muscle
Le professeur Leduc-Gaudet s’intéresse plus particulièrement à l’autophagie, un processus permettant aux cellules de décomposer et de recycler leurs propres composants, tels que les protéines endommagées, les organites dysfonctionnels et les déchets cellulaires.
L’autophagie est impliquée dans divers processus physiologiques et pathologiques en réponse au stress. Par exemple, il joue un rôle important dans le maintien de l’homéostasie musculaire – la capacité du muscle à maintenir son fonctionnement optimal – pendant l’exercice physique. Les dysfonctionnements de l’autophagie sont associés à un large éventail de conditions cliniques, notamment le cancer, les maladies neurodégénératives, la dystrophie musculaire, la septicémie, la sclérose en plaques et le vieillissement.

« On peut comparer l’autophagie à un système de recyclage. Celui-ci prend en charge les composants cellulaires endommagés ou excédentaires et les recycle ; si le système est moindrement altéré, les déchets – des agrégats protéiques et organites dysfonctionnels – ne sont pas recyclés et s’accumulent dans la cellule. Cela génère différentes cascades d’événements délétères pour la santé cellulaire et musculaire. En ce sens, nous croyons qu’il faut intervenir sur l’autophagie pour maintenir une homéostasie cellulaire en équilibre », vulgarise le chercheur de l’UQTR.
L’intérêt croissant de la communauté scientifique à comprendre les mécanismes cellulaires et moléculaires de l’autophagie s’explique par son impact sur la longévité et le vieillissement en santé. Dans cette perspective, Jean-Philippe Leduc-Gaudet se spécialise notamment dans la découverte de gènes méconnus qui favorisent le maintien de l’équilibre dans le système musculaire.
 Deux gènes prometteurs
Deux gènes prometteurs
Le chercheur et son équipe souhaitent ainsi proposer de nouvelles cibles thérapeutiques qui permettront d’intervenir sur le processus d’autophagie et, ainsi, prévenir ou inverser la perte de masse musculaire. « Si, par exemple, le processus d’autophagie n’est pas suffisamment activé, en d’autres termes que le système de recyclage est défaillant, alors est-ce qu’on peut intervenir de façon équilibrée, sans générer une dégradation excessive des composants cellulaires sains ? Je pense que oui », soutient M. Leduc-Gaudet, qui a obtenu le prix de la publication biomédicale de l’année du Réseau canadien sur les maladies neuromusculaires (NMD4C) pour son article publié dans la revue scientifique Nature Communications en 2023.
Sous sa loupe se trouvent actuellement deux gènes qui, par leur interaction, jouent un rôle dans la santé musculaire. Ces deux gènes, MYTHO (macro-autophagy and youth optimizer) et BCAS3 (breast carcinoma amplified sequence 3), agissent sur la régulation de l’autophagie et sont des acteurs cruciaux pour, entre autres, motiver la membrane de la cellule à recycler les composants cellulaires dysfonctionnels.
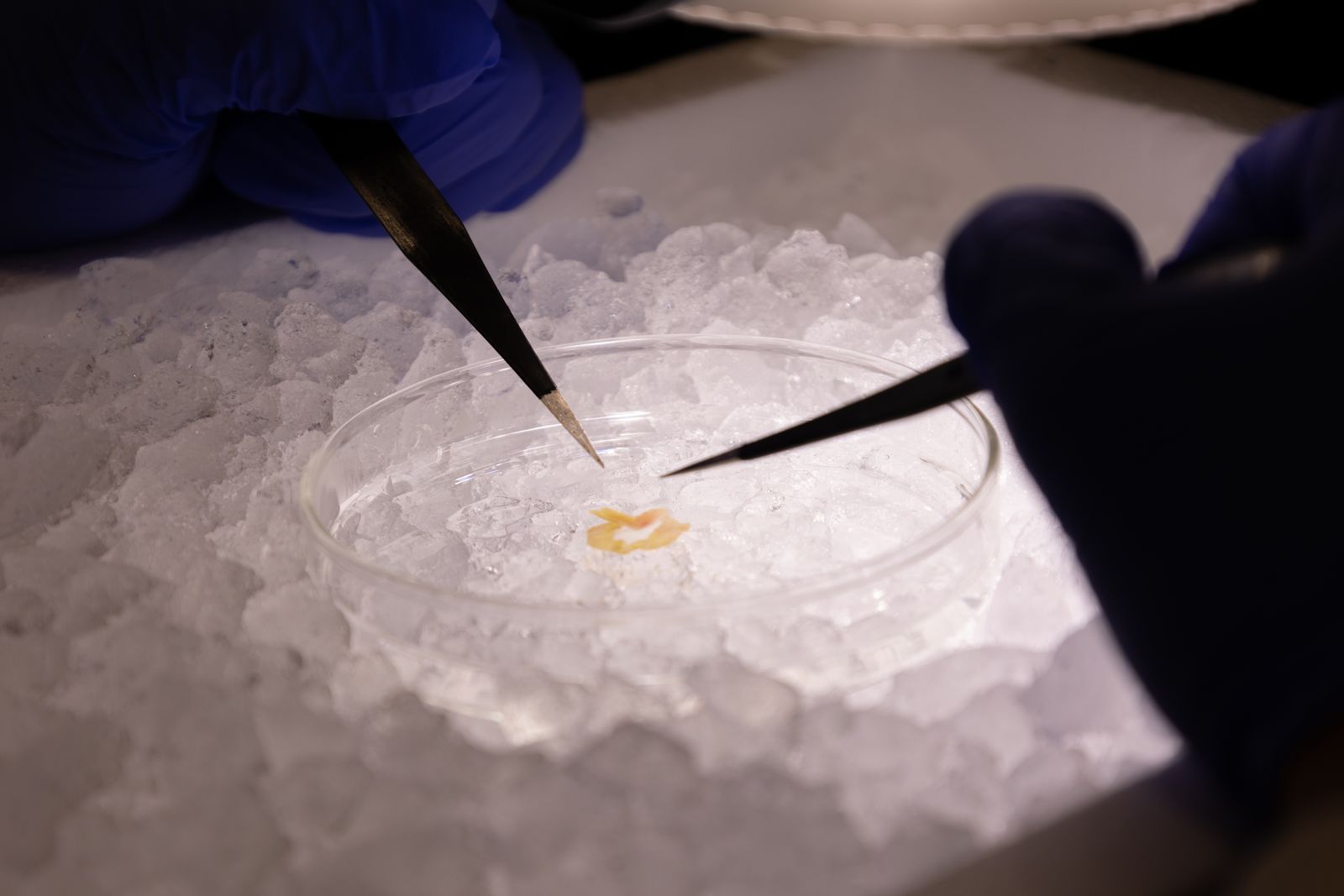
Séparation des fibres d’un diaphragme pour l’étude de la respiration mitochondriale en utilisant la technique des fibres perméabilisées.
MYTHO interagit avec BCAS3, un régulateur protéinique majeur qui initie le processus de l’autophagosome, créant un « sac de recyclage » à l’intérieur de la cellule en vue de capturer les composants dysfonctionnels et les acheminer vers les lysosomes pour la dégradation. La fusion du phagosome avec un lysosome, un organite très acide qui va dégrader les agrégats de protéines, est à l’œuvre dans le processus d’autophagie.
Il a ainsi démontré l’implication de MYTHO, un gène qu’il a lui-même découvert, dans la régulation de l’autophagie. « Nous avons révélé que la diminution de l’expression de MYTHO est associée au degré de sévérité des patients atteints de dystrophie myotonique de type 1 (DM1), une maladie neuromusculaire. Nous pensons qu’il est également à l’œuvre dans d’autres pathologies, mais le fait qu’il n’ait jamais été étudié auparavant nous demande de pousser plus loin nos investigations », conclut Jean-Philippe Leduc-Gaudet, en précisant que son équipe utilise des stratégies expérimentales combinant des approches génétiques, moléculaires, cellulaires et physiologiques afin d’étudier les voies de signalisation régulant la masse et la fonction des muscles.


